ACIDOS Y BASES
Objetivo:
El objetivo de esta practica de " acidos y bases " es poder averiguar atraves de unos procesos experimentales, que nivel de ph tienen los reactivos como el agua,...
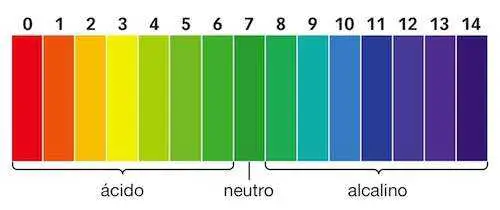
Para ello se usa un indicador de PH puede ser el naranja de metilo o puede ser el papel de ph, que segun del color que obtenga tras el proceso experimental, es mas acido o mas base, en cxaso de que no sea ni acido ni base es " PH nueutro"El color obtenido en el papel de PH se compara con la siguiente tabla :
Materiales:
- Vaso de precipitados
 |
- Tubo de ensayo
 |
- Pinzas de laboratorio
 |
- Cuentagotas
 |
- Embudo
 |
- Cuchara de laboratorio
 |
- Vidreo de reloj
|
- papel de ph
 |
Reactivos :
- Agua
 |
- Acido acetico
 |
- Acido clorhidrico
 |
- Zumo de limon
 |
- Bicarbonato sodico
 |
- Hidroxido sodico
 |
- Amoniaco
 |
- Naranja de metilo
 |
- Fenoltaleina
 |
Proceso experimental
- PASO 1 = Identificar los rectivos, poniendo debajo su nombre, para evitar confusiones
- PASO 2 = Para empezar vamos a medir la cantidad de PH que hay en el hidroxido sodico y en el zumo de limon, para calcular el ph de estos vamos a hacerlo con indicador de PH Fenoltaleina.

- PASO 3 = Vamos a calcular las medidas que se van usar para medir el PH
+ añadiremos 50 ml de agua y unas gota de fenolftaleina A sobre un vaso de precipitados.8( El resultado obtenido es un color morado)( Es una ACIDO)
+ añadiremos hidroxido sodico al agua con fenoltaleina con ayuda de una cuhara ( El resultado obtenido el un color gris amarillento ) ( Este color corresponde con un BASE)
+ añadiremos al final zumo de limon, para quitar el exceso de "BASE" que hay 87El limpon es un ACIDO por lo que se queda neutroy de color transparente el resultado restasnte)
- PASO 4 = vamos a realizar las medidas de `PH usando el naraja de metilo, para ello usaremos acido acetico y acido clohidrico, como productos pra calcular su nivel de PH ,
+ El acido acetico obtiene un color naranja amarillo
+ El acido clorhidrico al medir su PH indica que es un acido, bastante potente, seria el 0 en la tabla de PH
-PASO 5 = con ayuda del papel de ph uno de los dos tipos y con ayuda de las pinzas vamos a calcular el nivel de ph, de todos y los vamos a comparar con la tabla de PH


+ En el caso de limon indica un color verde clarito, por los que pose un numero de 6es un acido
+ El amoniaco, en cambio posee un color azulado por lo que podria estar entre el 9 y el 11, considerandosde base ( fuerte)
+ El bicarbonato es una bvase (floja) por lo que pose un color verde azulado, que coincide con el 8
Definicion / concepto :
ACIDO :
Sustancia capaz de ceder protones que se caracteriza por provocar cambios de color en sustancias orgánicas, naturales o sintéticas y por reaccionar muy rápidamente con sustancias de otro grupo (bases); se designa con el nombre genérico ácido, seguido de un nombre específico que se forma por adjetivación del elemento que hace de átomo central.
Base : Una base es, en primera aproximación, cualquier sustancia que en disolución acuosa aporta iones OH− al medio.


EJERCICIOS:
+) ¿ Que tipo de sustancias son la legia o el amoniaco ?¿ Cual es su principal uso cotidiano?
la legia o el amoniaco son bases, principalmente se usa para la limpieza, ya que es una base y no permite la vida de seres vivos en su entorno , no permitiedo inbsectos,...

+) El bicarbonato sodico se us apara combatir la acidez estomacal ¿ Te pareze coherente este uso '
es bueno si tienes acided de estomago , porque al ser una base, permitira que no haya acidez quedandose neutro.

es bueno si tienes acided de estomago , porque al ser una base, permitira que no haya acidez quedandose neutro.

+) ¿Porque razon volvio a quedar transpatrente la disolucion de hidroxido sodico ( NaOH ) CON FENOLTALEINA, cuando se le añadio zumo de limon ?
La feltaleina con hidroxido sodico ( Naoh ) forman una base, si a una base le hechas un acido se nqueda neutro ( PH neutro) En este caso la fenoltaleina es un indicador de PH y tiene color con Hidroxido sodico, porque este es una base, al hecharle el acido ( zumo de luimon) , se vuelve transàrente indicando un estado NEUTRO
La feltaleina con hidroxido sodico ( Naoh ) forman una base, si a una base le hechas un acido se nqueda neutro ( PH neutro) En este caso la fenoltaleina es un indicador de PH y tiene color con Hidroxido sodico, porque este es una base, al hecharle el acido ( zumo de luimon) , se vuelve transàrente indicando un estado NEUTRO
+) La lluvia acida es uno de los fenomenos medioambientales mas preocupantes, en los ultimoas tiempos ¿ En que consiste este efecto? ¿Cuales son sus principales causas?¿ Y sus consecuencias?
la lluvia acida es agua contaminada que cae a la tyierra atraves de las lluvias esta lluvia es muy peligrosa medioambientamente ya que mata a las planatas y perjudicial para los seres vivos ya sean animales o personas
la lluvia acida es producida por la contaminacion que producen las fabricas, coches,... L alluvia acida el agua 8 H2O) + un elemento ACIDO. es ese el acido perjudicial. El peligro principal de la lluvia acida es que puede llegar a romper ecosistemas, compo remedio se podrian poner leyes npara prevenir la cantidad excesiva de contaminacion a la atmosfera
la lluvia acida es agua contaminada que cae a la tyierra atraves de las lluvias esta lluvia es muy peligrosa medioambientamente ya que mata a las planatas y perjudicial para los seres vivos ya sean animales o personas
la lluvia acida es producida por la contaminacion que producen las fabricas, coches,... L alluvia acida el agua 8 H2O) + un elemento ACIDO. es ese el acido perjudicial. El peligro principal de la lluvia acida es que puede llegar a romper ecosistemas, compo remedio se podrian poner leyes npara prevenir la cantidad excesiva de contaminacion a la atmosfera























